Ziel unserer Forschung ist die Entwicklung innovativer Zellkulturtechnologien für die Herstellung relevanter Zellkulturmodelle für die Wirkstofftestung und die Entwicklung neuer zellbasierter Therapien.
Ziel unserer Forschung ist die Entwicklung innovativer Zellkulturtechnologien für die Herstellung relevanter Zellkulturmodelle für die Wirkstofftestung und die Entwicklung neuer zellbasierter Therapien.

 ©
Created with BioRender.com
©
Created with BioRender.com
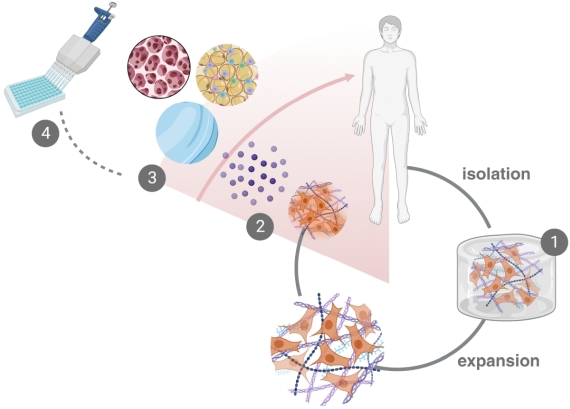
Unser Forschungsbereich hat sich das Ziel gesetzt, innovative Zellkulturtechnologien für die Herstellung relevanter Zellkulturmodelle für die Wirkstofftestung und die Entwicklung neuer zellbasierter Therapien zu entwickeln. Dazu sollen die Zellen zu jedem Zeitpunkt der Kultur in einer möglichst natürlichen, körperähnlichen Umgebung kultiviert werden – von der Isolation (1) über die Vermehrung bis zu der Produktion von Stammzellen und Stammzellprodukten (2), der finalen Differenzierung (3) oder der anschließenden Wirkstofftestung (4). Um physiologische Bedingungen während der Kultur zu gewährleisten, entwickeln und verwenden wir 3D-Zellkulturtechnologien und Bioreaktorsysteme, welche in einer hypoxischen (sauerstoffreduzierten) Umgebung betrieben werden. Unter solchen physiologischen Kulturbedingungen verhalten sich Zellen eher wie im menschlichen Körper – Forschungsergebnisse sind dadurch aussagekräftiger und klinisch relevant.
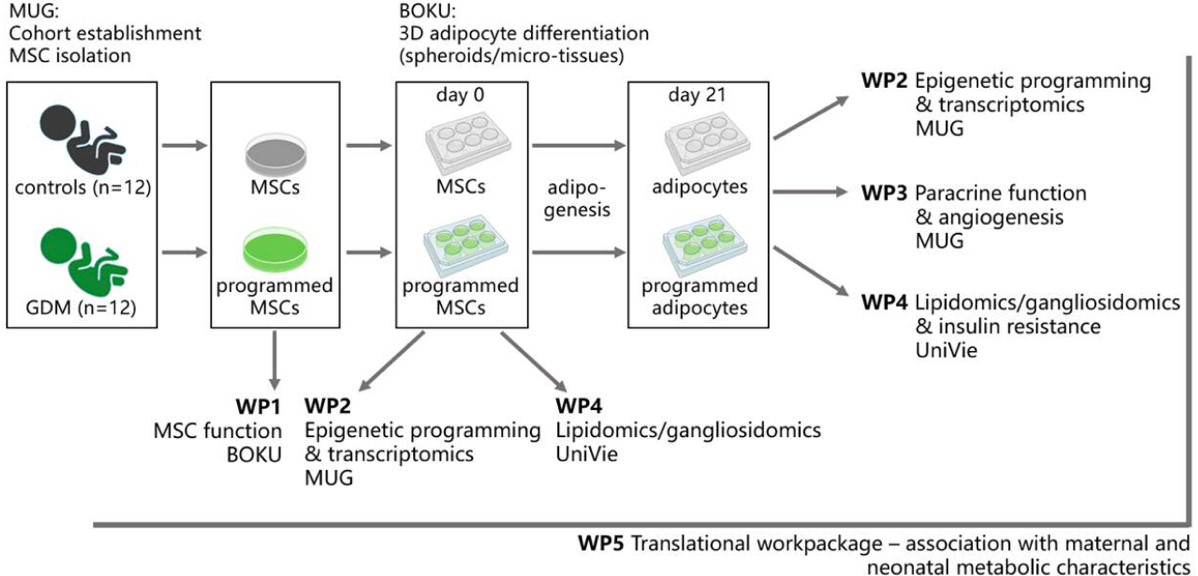
Prone Adiposity
Programmierung von neonatalem Fettgewebe durch maternalen Schwangerschaftsdiabetes
Das Projekt „Prone Adiposity“ ist ein gemeinsames Forschungsprojekt, das vom Österreichischen Wissenschaftsfonds (FWF) finanziert wird. Es untersucht, wie sich Schwangerschaftsdiabetes (GDM) auf die Entwicklung von Fettgewebe bei Neugeborenen auswirkt. GDM ist ein Zustand, bei dem werdende Mütter während der Mitte der Schwangerschaft aufgrund von Hormonen, die von der Plazenta produziert werden, eine Insulinresistenz entwickeln. Zu den Haupt-Risikofaktoren zählen Übergewicht, eine familiäre Diabetes-Vorgeschichte und höheres Alter. Derzeit betrifft GDM 16 % der Schwangerschaften in Österreich und wird weltweit immer häufiger. Dieser Zustand trägt erheblich zur Fettleibigkeitsepidemie bei, indem er die Entwicklung von Fettgewebe im Mutterleib beeinflusst.
-
Untersuchung der Vererbung von Stoffwechselkrankheiten
Um zu verstehen, wie Stoffwechselkrankheiten wie Diabetes über Generationen hinweg vererbt werden, untersuchen wir mesenchymale Stammzellen (MSCs) aus den Nabelschnüren von sowohl gesunden als auch GDM-betroffenen Schwangerschaften. Wir vergleichen diese Zellen hinsichtlich ihres Wachstums, ihrer Fähigkeit, sich in andere Zelltypen zu verwandeln, ihrer genetischen und epigenetischen Profile, ihrer Sekretionsaktivität, ihrer Insulinresistenz und ihrer Fettzusammensetzung.
-
Fortschrittliche Labormethoden
Unsere Experimente werden unter Verwendung fortschrittlicher Zellkulturtechniken durchgeführt, um die physiologischen in-vivo-Bedingungen nachzuahmen, einschließlich 3D-Zellkulturen, sauerstoffarmer Umgebungen (Physioxie) und Medien ohne tierische Komponenten. Diese Methoden tragen dazu bei, dass unsere Laborergebnisse so realitätsnah wie möglich sind.
-
Zusammenarbeit
Das Projekt umfasst vier Universitäten, die jeweils zu verschiedenen Aspekten der Forschung beitragen:
- Medizinische Universität Graz (Ursula Hiden): Epigenetische Reprogrammierung, Transkriptomanalysen und parakrine Funktion von MSCs und dem resultierenden Fettgewebe von gesunden und GDM-Spendern.
- Leibniz Universität Hannover (Dominik Egger) in Zusammenarbeit mit der Universität für Bodenkultur Wien (Cornelia Kasper): Erzeugung von funktionellem Fettgewebe aus MSCs von gesunden und GDM-Spendern. Funktionelle Charakterisierung der MSCs und des daraus resultierenden Fettgewebes von gesunden und GDM-Spendern.
- Universität Wien (Evelyn Rampler): Analyse der Lipid- und Gangliosidzusammensetzungen sowie metabolische Flussanalysen. Die Proben werden zwischen diesen Institutionen ausgetauscht, um eine umfassende Analyse zu gewährleisten und verschiedene Faktoren gründlich zu untersuchen.
Das Projekt "Prone Adiposity" zielt darauf ab, herauszufinden, wie GDM die Entwicklung von Fettgewebe bei Neugeborenen beeinflusst. Dies trägt zu einem besseren Verständnis der intergenerationalen Übertragung von Fettleibigkeit und Stoffwechselkrankheiten bei. Durch gemeinsame Forschung und fortschrittliche Techniken hoffen wir, neue Erkenntnisse zur Prävention und Behandlung dieser Erkrankungen zu gewinnen.
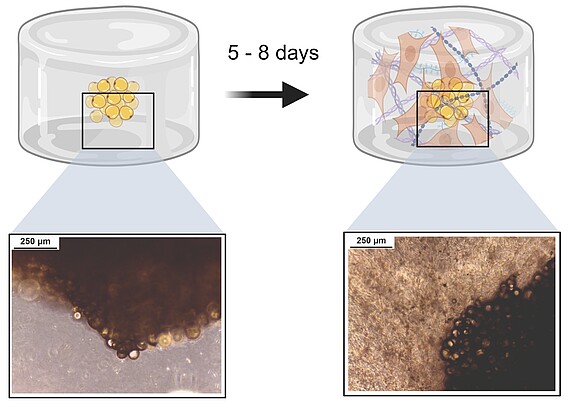
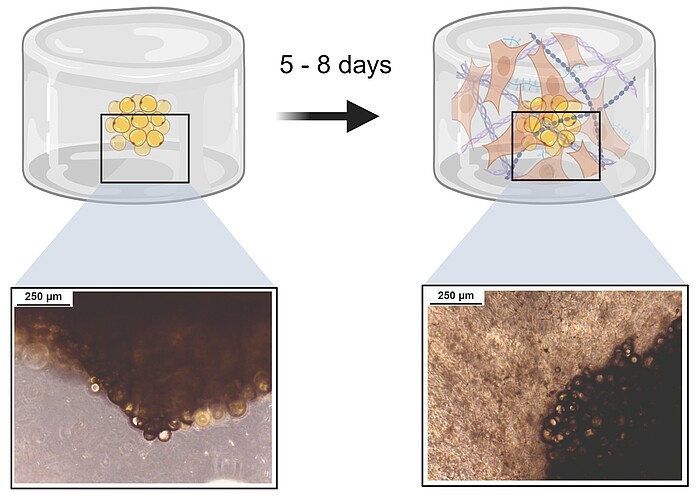
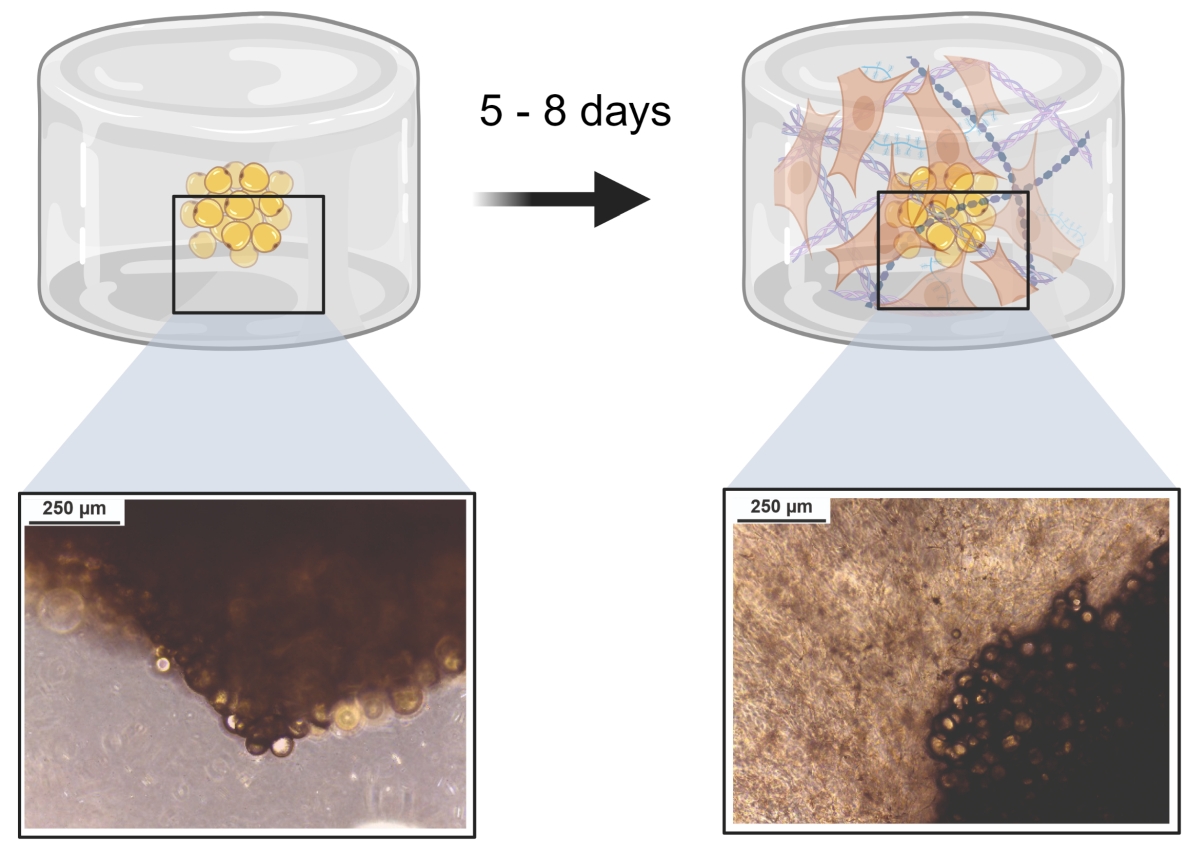
3D-Isolation von Stammzellen
 ©
Created with BioRender.com
©
Created with BioRender.com
Um Vorläufer- und Stammzellen aus Spendergewebe zu gewinnen, werden üblicherweise artifizielle 2D-Kunststoffoberflächen (T-Flasche, Petrischale etc.) für die Kultur verwendet. Dies ist jedoch nicht physiologisch. Wir forschen an neuen Methoden, um Stammzellen aus einem natürlicherweise 3D-Gewebe direkt wieder in eine 3D-Umgebung zu isolieren – ganz ohne Kontakt zu üblicherweise genutzten 2D-Oberflächen. Dafür verwenden wir verschiedene Hydrogele und passen diese auf die jeweiligen Spendergewebe an. So konnte bereits ein System etabliert werden, mit dem die direkte Isolation von Stammzellen aus Fettgewebe in einem Hydrogel möglich ist.
Stammzellen und Stammzellprodukte als Wirkstoffe



Mesenchymale Stammzellen haben ein außerordentliches Potenzial für therapeutische Anwendungen im Bereich der Regenerativen Medizin. Diese heterogene Population von Zellen kann einerseits zur Regeneration von beschädigtem Gewebe beitragen, aber auch für die Regulation des Immunsystems genutzt werden. Dieses ist besonders in systemischen inflammatorischen Zuständen von Interesse. Auch extrazelluläre Vesikel (EVs), welche von Stammzellen sekretiert werden, haben therapeutische Effekte, wie die Stammzellen selbst und sind daher von großem Interesse.
Auch für die Produktion von Stammzellen und deren Produkte hat sich bestätigt, dass physiologische Zellkulturbedingungen das therapeutische Potenzial verbessern können. Daher entwickeln wir auch für diese Bereiche Methoden, um Stammzellen und Stammzell-EVs in 3D und unter definierten physiologischen Bedingungen in maßgeschneiderten Bioreaktoren herzustellen.
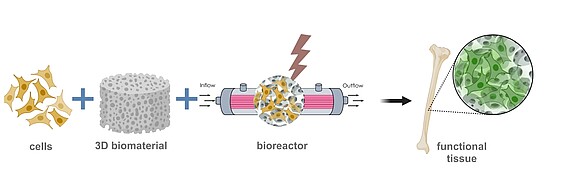
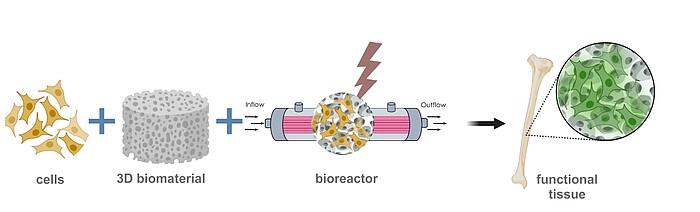
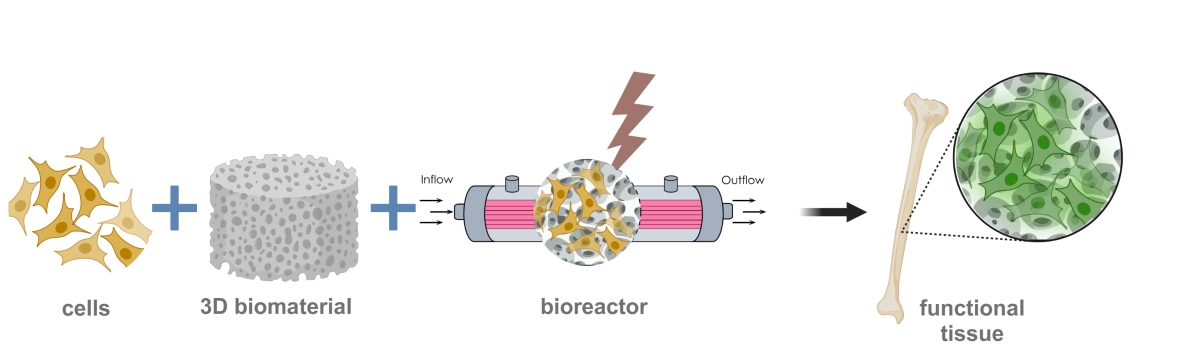
3D-Zellkulturmodelle
Um physiologisch relevante 3D-Zellkulturmodelle herzustellen, müssen Vorläufer- und Stammzellen in einer 3D-Umgebung zu verschiedenen Zelltypen ausdifferenziert werden. Dafür können entweder Biomaterialien als Trägerstruktur verwendet oder 3D-Strukturen aus Zellaggregaten (Sphäroiden) hergestellt werden. Um eine gezielte Differenzierung durchführen zu können, werden physikalische, chemische und biologische Parameter während der Kultur so eingestellt, dass sie möglichst der natürlichen Umgebung des Zielgewebes entsprechen. Dafür verwenden und entwickeln wir moderne und miniaturisierte Bioreaktorsysteme. Das gesamte Kultursystem passen wir so an, dass am Ende des Prozesses ein möglichst funktionales Gewebe entsteht.
 ©
Created with BioRender.com
©
Created with BioRender.com
Wirkstofftestung
Neuartige Wirkstoffe müssen in Zellkulturmodellen getestet werden, bevor ein potenzieller therapeutischer Effekt in klinischen Studien am Menschen untersucht werden kann. Wir forschen an humanen physiologischen Zellkulturmodellen, welche das therapeutisch relevante Geschehen möglichst gut widerspiegelt, sodass die Ergebnisse aussagekräftig sind. Hierfür müssen die Zellkulturmodelle insofern angepasst werden, dass sie für Testung im mittleren oder hohen Durchsatz geeignet sind.
Kontakt


30419 Hannover